|
|

 |
 |
 |

 |
 |
En 2004, A. Vania Apkarian a utilisé
l’imagerie par résonance magnétique pour comparer les cerveaux de personnes saines
à ceux de patients souffrant de douleurs chroniques au dos. Il a observé un amincissement
de la matière grise du cerveau comparable à la perte de matière grise
observée en 10 ou 20 ans de vieillissement. Et plus la personne vivait avec cette
douleur chronique depuis longtemps, plus le volume de matière grise était diminué.
Cette perte était particulièrement évidente au niveau du thalamus et du cortex
préfrontal, une région associée à la résolution de problèmes. Or Apkarian avait
déjà observé que les patients souffrant de douleurs chroniques prennent plus de
temps pour résoudre certains tests d’habiletés mentales que les personnes saines.
On connaît bien l’effet
néfaste du stress sur certains neurones du cerveau impliqués notamment
dans la mémoire. Il demeure toutefois difficile d’affirmer si c’est le stress
lié à une douleur chronique qui est directement à l’origine de l’amincissement
de la matière grise ou si le stress ne serait pas plutôt à l’origine de la douleur
chronique, et la douleur par la suite responsable de la diminution du volume cérébral.
|
Des études montrent une activation
du noyau
accumbens, région clé du circuit
de la récompense, durant certaines expériences faisant usage de stimuli nociceptifs.
De plus, cette activation serait liée dans plusieurs cas à une variation du taux
d’endorphine
au voisinage du nucleus accumbens. Le fait que la dopamine
est aussi impliquée dans l’analgésie produite par l’effet
placebo est une donnée qui va dans le même sens puisque les neurones du
noyau accumbens sont très sensibles à ce neurotransmetteur que l’aire
tegmentale ventrale leur envoie. Ces résultats tendent à appuyer la
thèse voulant qu’il existe des mécanismes physiologiques précis derrière ce que
l’on perçoit subjectivement comme un continuum, à savoir le passage
de la douleur à l’arrêt de celle-ci, puis à des sensations agréables ou fortement
plaisantes. Cette conception que le plaisir et la douleur font partie
d’un même spectre remonte d’ailleurs à des penseurs comme Spinoza
et Bentham
qui l’ont mis de l’avant dans leur philosophie. | | |
| LA NEUROMATRICE DE LA DOULEUR |
| On
a cherché en vain un « centre de la douleur » dans le cerveau.
Si un tel centre avait existé, on aurait pu envisager d’atténuer
les douleurs
chroniques de millions de gens en en faisant l’ablation ou en essayant
de le neutraliser chimiquement. Mais ces efforts n’ont pas abouti. La douleur
est en effet un phénomène subjectif aux multiples dimensions, tant
discriminatives, affectives que cognitives. Il n’est donc pas étonnant
de découvrir qu’un stimulus nociceptif active de nombreuses
structures cérébrales qui vont interagir pour construire une
sensation douloureuse particulière. On découvre
aussi que l’activité dans ce réseau est très sensible
aux processus
de régulation « de haut en bas » (« top down »,
en anglais) ce qui expliquerait des phénomènes comme l’effet
placebo. Sans compter l’intégration d’une douleur particulière
avec notre expérience personnelle et notre héritage
culturel qui étend encore davantage le spectre des zones cérébrales
impliquées. Cela dit, on admet aujourd’hui
qu’il existe une spécialisation fonctionnelle au moins partielle
des régions cérébrales impliquées dans les différentes
composantes de la douleur. On tente donc maintenant d’associer à
ces différentes composantes des sous-ensembles de structures cérébrales
et de proposer ainsi un modèle fonctionnel global de la douleur. Étant
donné la complexité du phénomène dont veulent rendre
compte ces modèles, de vifs débats leur ont toujours été
associés. Grosso modo, on peut dire que la
conception sous-jacente aux théories de la douleur est passée d'une
causalité linéaire à une causalité circulaire. On
a pu d’abord parler d’une théorie de l’intensité,
où la douleur résulte de l’activité excessive de certains
nerfs qui ne lui sont pas nécessairement spécifiques. Puis, au XVIIe
siècle, René
Descartes fut l’un des premiers à parler de la douleur comme
d’une sensation spécifique, au même titre que la
vue, l’ouïe ou l’odorat. En 1894,
Von Frey énonce de façon explicite une théorie de
la spécificité des sensations. Pour lui, c’est le
type de terminaison nerveuse qui détermine la nature et la qualité
de la sensation perçue. L’information circule ensuite essentiellement
de la périphérie vers les centres supérieurs (où elle
rejoint quelque chose qui ressemble à un « centre de la douleur »),
pour redescendre ensuite en commande motrice sans grande altération. Cette
théorie ne laisse donc pas de place à des modulations d’origine
psychologiques comme l’attention
ou l’expérience passée qui donne un sens à une situation
particulière. Le cerveau et les relais sous-corticaux étant ici
rien de plus que des récepteurs passifs.
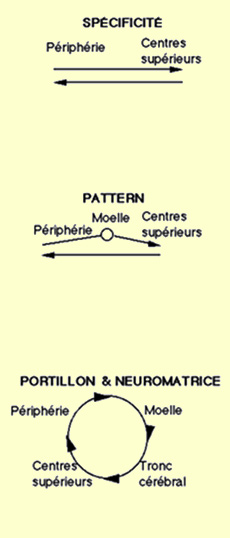
Source : Charest, Lavignolle, Chenard, Provencher
et Marchand, 1994 École interactionnelle du dos. Rhumatologie, 46, 221-237.
| | Incapable
d’expliquer convenablement des phénomènes comme la douleur chronique, la théorie
de la spécificité a par la suite fait place à différentes théories du
pattern (ou des patrons d’activation) qui ajoutent à cette voie ascendante
linéaire différents relais. Ceux-ci permettent d’amorcer une certaine intégration
de l’activité de fibres nerveuses ayant des propriétés réceptrices différentes,
intégration qui s’effectue par exemple au niveau de la substance
gélatineuse de la moelle épinière, des noyaux ventro-postérieurs du thalamus
et du cortex somatosensoriel. Le retour vers la commande motrice se fait ensuite
linéairement vers le bas. Le développement de la théorie
du portillon à partir des années 1960 et par la suite de la théorie
de la neuromatrice s’appuie sur le constat que la douleur résulte d'une
multitude d'interactions et d'échanges d'informations à plusieurs étages du système
nerveux. Et la modulation de l’information nociceptive ascendante se fait à chacun
de ces multiples relais avant d’être intégrée comme une perception douloureuse.
Ce modèle circulaire de la douleur permet surtout de mieux comprendre comment
les composantes nociceptives, discriminatives, affectives et comportementales
peuvent s'influencer mutuellement. | Le
concept de neuromatrice a été mis de l’avant par Ronald Melzack à la fin des années
1980 pour tenter d’expliquer l’étrange phénomène des douleurs
aux membres fantômes. Il est en effet très fréquent que des personnes amputées
ressentent des douleurs bien réelles qui leur semblent provenir du membre amputé.
Ce phénomène illustre clairement que la douleur n’est pas générée par un système
à sens unique. Pour l’expliquer, Melzack propose que c’est l’activité nerveuse
dans un réseau comprenant plusieurs structures cérébrales qui générait la douleur.
Et ce réseau pouvait même générer de la douleur sans qu’il n’y ait de stimulus
sensoriel déclencheur. Dans le cas des douleurs fantômes,
un conflit entre la rétroaction visuelle et les représentations proprioceptives
du membre amputé pouvait induire dans la neuromatrice une confusion génératrice
de douleur. L’utilisation d’un miroir pour donner l’illusion visuelle au patient
qu’il a par exemple à nouveau sa main amputée s’est d’ailleurs montrée efficace
pour apaiser certaines douleurs fantômes.
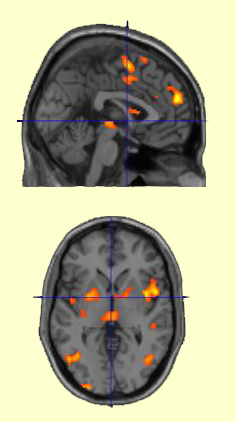
Activation
de régions de la neuromatrice de la douleur, dont l’insula, le cortex cingulaire
antérieur, la substance grise périaqueducale, le cortex préfrontal médian et l’aire
motrice supplémentaire. | | Cette
matrice de la douleur, ou neuromatrice, constitue donc l’ensemble des régions
du cerveau dont l’activité varie lors d’une expérience douloureuse. C’est un vaste
espace neuronal où peuvent être codés différents
types de douleur. Chacune de ces douleurs singulières auront ce que Melzack
appelle une «neurosignature» particulière, c’est-à-dire un pattern
d’activation unique de la neuromatrice ou d’un sous-ensemble de celle-ci. D’autres
emploient l’expression d’assemblée
de neurones pour décrire ce type d’association neuronale. Et comme les connexions
des cerveaux de chaque individu sont différentes dans le détail, les neurosignatures
de chaque individu sont forcément différentes. De même,
les connexions synaptiques étant modifiables avec l’expérience, une neurosignature
va être structurellement différente dans un même cerveau avec le temps qui passe.
| Pour tenir compte de toutes les
facettes du phénomène des douleurs fantômes, Melzack a proposé une neuromatrice
comprenant de
nombreuses structures cérébrales impliquées tant dans l’aspect discriminatif,
affectif, cognitif et moteur de l’expérience douloureuse des amputés. Sa
neuromatrice incluait au moins trois circuits neuronaux majeurs dont l’importance
a été confirmée par les nombreuses études d’imagerie cérébrale qui ont suivi.
D’abord une voie nociceptive ascendante spinothalamique latérale discriminative,
qui comprend les noyaux ventropostérieurs du thalamus et le cortex somatosensoriel.
Ensuite une voie spinothalamique médiane plutôt affective et motivationnelle
impliquant le tronc cérébral, les noyaux ventro-médians du thalamus, le système
limbique et le cortex frontal). Et finalement des régions associatives
du cortex pariétal inférieur. Le tableau s’est aussi
enrichi de régions comme le cortex orbitofrontal, préfrontal (dans les aires de
Brodmann 9, 10, 44), moteur (comme l’aire 6 de Brodmann et le cortex
moteur supplémentaire), sans oublier certaines régions du mésencéphale
comme celle de la substance
grise périaqueducale et du noyau lentiforme (ou lenticulaire). Des
régions comme le cortex cingulaire
antérieur et l’insula sont même devenues aux yeux de plusieurs des régions
clé dont l’activation va nécessairement de pair avec certaines facettes de la
douleur, notamment sa composante affective. Sans revenir en arrière et en faire
des « centres de la douleur », les neurones de ces régions montrent une grande
spécificité à certains aspects de la douleur. Ce qui montre que la neuromatrice
de la douleur peut avoir des « nœuds » dont l’activité est plus significative
que d’autres. |
|