|
|
| Un livre accompagne le site depuis octobre 2024. Découvrez-le ici > |  |
|
|
|
|
||||
|
|
||||||
|
|
|
|
| |
La richesse éloigne les riches de leur humanité Stimuler ou inactiver des régions cérébrales, d’hier à aujourd’hui La biologie cérébrale a son mot à dire dans nos allégeances politiques Des circuits de millions de neurones : plaisir, douleur, apprentissage, mémoire
| |
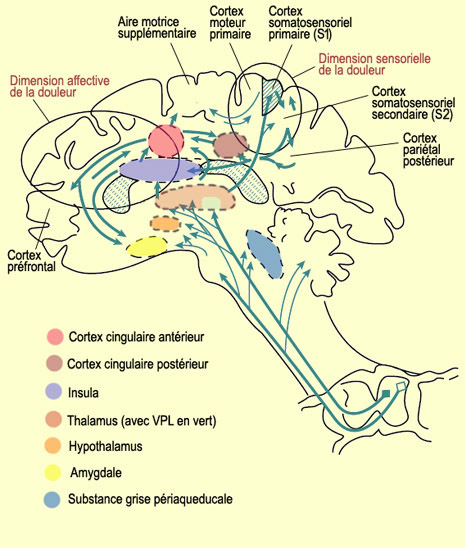
La multiplicité des voies ascendantes de la nociception suggère que celles-ci ne dépendent pas d’un système unique se terminant dans un « centre de la douleur » quelque part dans le cerveau. Au contraire, la perception de la douleur est prise en charge par de nombreuses structures cérébrales, ce qui confirme les multiples facettes du phénomène. Après avoir rejoint la formation réticulée du tronc cérébral, puis certains noyaux du thalamus, le message douloureux atteint le cortex cérébral. Le cortex somatosensoriel primaire (ou S1) reçoit les axones des neurones thalamiques du noyau ventral postérolatéral (ou VPL) tandis que le cortex somatosensoriel secondaire (ou S2) reçoit les informations nociceptives à la fois de l’aire S1 et des noyaux thalamiques. Si on assigne généralement à S2 un rôle dans la reconnaissance de la douleur et la mémoire des douleurs passées, S1 est associé pour sa part à la discrimination des différentes propriétés de la douleur. L’organisation somatotopique est en effet préservée jusqu’au cortex S1 et rend possible la localisation de l’endroit douloureux sur le corps. Le degré d’activité des neurones de S1 correspond quant à lui à l’intensité du stimulus douloureux. Par exemple, plus l’eau qui coule sur votre main est chaude, plus vos neurones du cortex S1 vont déclencher d’influx nerveux. Les études d’imagerie cérébrale montrent que plus l’activité corticale dans S1 est intense, plus la douleur est évaluée comme intense subjectivement par le sujet. D’autres études d’imagerie utilisant l’hypnose pour suggérer au sujet que l’intensité du stimulus douloureux est moindre que ce qu’elle est en réalité ont d’ailleurs démontré une diminution d’activité dans le cortex S1 dans ces conditions. Fait remarquable, si la suggestion hypnotique portait sur le caractère plus ou moins déplaisant du stimulus, l’activité dans le cortex S1 demeurait constante. Cependant, celle du cortex cingulaire antérieur, associée à la composante affective de la douleur, variait pour sa part en fonction de la suggestion, confirmant des rôles distincts pour ces deux régions.
On explique cette association entre les affects négatifs de la douleur et l’activité du cortex cingulaire antérieur par le fait que celui-ci intègre les inputs sensoriels au traitement cognitif. Cela permet de produire une réponse motrice appropriée à la stimulation douloureuse, comme des comportements d’évitement. L’émotion étant liée à la motivation et celle-ci à l’action, on comprend l’importance du cortex cingulaire antérieur dans les réactions affectives à la douleur qui nécessitent une réponse comportementale immédiate. Et si c’est la partie antérieure du cortex cingulaire qui est la plus souvent citée quand on parle de la douleur, les travaux de Burkhart Bromm montrent que c’est d’abord le cortex cingulaire postérieur qui répond le premier au message nociceptif (environ 220 millisecondes après la stimulation nociceptive). Cette activité se déplace par la suite vers les parties médianes et antérieures du cortex cingulaire, avant de s’éteindre dans le cortex frontal autour de 300 millisecondes après le début du stimulus. C’est aussi le cortex cingulaire postérieur qui permettrait de fondre en une perception unifiée l’affect négatif de la douleur à sa localisation, sa nature et son intensité grâce à ses connexions au cortex pariétal reconnu pour son rôle dans l’intégration de modalités sensorielles. La partie postérieure du cortex pariétal intervient également dans l’attention au stimulus douloureux, de même que la région dorsolatérale du cortex préfrontal droit qui fait aussi partie de ce réseau cortical attentionnel. On sait en effet à quel point le détournement de l’attention du stimulus douloureux peut diminuer la sensation subjective de douleur, et comment ce bien-être ressenti s’accompagne d’une diminution réelle d’activité dans des régions cérébrales associées à la douleur.
Le cortex préfrontal n’est pas seulement impliqué dans les fonctions dites «supérieures» impliquant souvent l’attention, mais aussi dans l'apprentissage des sensations nociceptives, et donc dans le développement d’un affect négatif associé à ces situations. Il est donc extrêmement bien placé pour avoir son mot à dire sur l’anticipation et le contrôle de la douleur. Par exemple, lors d’expériences conçues pour inciter le sujet à anticiper la venue de chocs électriques douloureux, ceux-ci étaient appliqués dans deux conditions : sans crème, et avec une crème placebo présentée comme analgésique. Durant la condition placebo, outre le fait que les sujets rapportent une douleur moindre, on observe une diminution concomitante de l’activité nerveuse dans des régions associées à la douleur comme le thalamus, le cortex somatosensoriel primaire et secondaire, le cortex cingulaire antérieur et le cortex insulaire (ou insula). Cependant, l'anticipation d’une douleur moindre dans cette condition placebo amène au contraire une augmentation d’activité électrochimique dans le cortex préfrontal ainsi que dans une région du mésencéphale incluant la substance grise périaqueducale. Le cortex préfrontal étant également associé à certaines formes de mémoire de travail, autrement dit au maintien temporaire d’idées, d’informations ou de pensées en vue d’un contrôle cognitif, on voit comment tout cela pourrait lui permettre de jouer un rôle dans l’anticipation d’un soulagement à l’origine de l’effet placebo.
Quant à la substance grise périaqueducale, son activation en parallèle avec le cortex préfrontal durant l’anticipation d’un soulagement va dans le sens de l’hypothèse déjà avancée voulant que des mécanismes préfrontaux déclenchent la libération d’opioïdes endogènes dans la substance grise périaqueducale durant l’effet placebo. De plus, ce noyau du mésencéphale reçoit de l’information de nombreuses structures cérébrales liées à l’intégration des processus émotionnels. La région de la substance grise périaqueducale reçoit aussi des afférences des fibres nociceptives ascendantes susceptibles elles aussi de déclencher les mécanismes de contrôles descendant qu’exerce cette région sur les neurones de la corne dorsale de la moelle épinière. On sait maintenant que cette analgésie endogène peut être déclenchée par la stimulation de plusieurs autres structures sous-corticales, allant du bulbe au diencéphale. C’est le cas notamment du noyau du raphé (l’un des plus efficaces avec la substance grise périaqueducale), du noyau réticulaire latéral, du noyau du tractus solitaire, du locus coeruleus, de l’aire parabrachiale et de hypothalamus latéral.
D’autres structures sous-corticales contribuent à différents phénomènes associés à la douleur. Ainsi, l’envoi d'informations nociceptives de la formation réticulée et du thalamus non spécifique à la structure régulatrice végétative par excellence qu’est l’hypothalamus sera à l'origine de l’augmentation de la sécrétion des hormones de stress et de l’activation du système nerveux sympathique. Les mêmes projections, en activant le striatum, favoriseront les réponses motrices d’alarme en grande partie automatiques déclenchées par une stimulation douloureuse. Les interconnexions importantes entre le cortex cingulaire antérieur et l’amygdale, un haut lieu de la régulation viscérale émotionnelle, expliquent la sudation, l’accélération du rythme cardiaque, l’augmentation de la tension artérielle ou les nausées provoquées par une douleur intense.
Finalement, la localisation anatomique particulière de l’insula, ainsi que ses liens privilégiés avec le système limbique en font un candidat idéal pour servir d’interface entre l’information sensorielle en provenance du corps et l’état cognitif particulier d’une personne à un moment donné. Car une sensation subjective comme la douleur est construite justement par l’intégration de cette information sensorielle et cognitive. Or l’insula (plus spécialement l’insula antérieure droite) est l’une des structures cérébrales les plus fréquemment activées non seulement directement par un stimulus douloureux, mais aussi lorsqu’une personne regarde des images de situations douloureuses et imagine que c’est elle qui les subit. Les recherches portant sur les bases neuronales de l’empathie révèlent ainsi une superposition partielle des aires cérébrales actives lors d’une douleur subie versus une douleur observée chez quelqu’un d’autre, superposition qui comprend l’insula et le cortex cingulaire antérieur. La vue d’une image évoquant la peur, un autre affect négatif proche de la douleur, entraîne pour sa part l’augmentation d’activité dans le cortex cingulaire antérieur et dans des structures comme l’amygdale, mais pas dans l’insula. Si la peur et la douleur provoquent tous les deux un état émotionnel désagréable associé à une réaction de retrait et de protection, on voit que leurs bases neurologiques ne sont encore une fois que partiellement superposables. |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |
|
|
|
|
|
|
|
|