|
|



Une autre composante dédiée
au temps dans le cerveau ressemble davantage à un chronomètre qu’à
une horloge. Au lieu de donner une référence temporelle absolue
comme une horloge, ce « chronomètre mental »
nous permet d’estimer le temps qui s’écoule à partir
d’un événement donné. Par exemple, quand un feu de
circulation passe au jaune, nous déciderons de continuer ou pas en fonction
du temps écoulé depuis le passage au jaune.
Ce chronomètre
interne qui nous permet d’avoir conscience du temps qui s’écoule
mettrait en jeu le cortex, le thalamus, ainsi qu’une structure dont le rôle
serait central dans ce calcul : le
striatum des ganglions de la base. |

Plus
de lumière le jour, moins endormi le soir
Une
protéine cryptochrome à l’origine de la magnétoréception
chez les oiseaux
|
|
| LES ROUAGES DE L'HORLOGE BIOLOGIQUE |
| Depuis la découverte
du premier gène impliqué dans le cycle circadien de la mouche drosophile
en 1971 (voir capsule histoire à gauche), puis celle du gène Clock
chez la souris en 1997, on a appris beaucoup de choses sur les rouages moléculaires
des horloges biologiques des différentes espèces.
On s’est
d’abord aperçu qu’elles s’appuient toutes sur des boucles
de rétroaction négatives (voir capsule outil à gauche) où
des
protéines reviennent dans le noyau inhiber leur propre production.
Ainsi, chez les mammifères, les
gènes Period (Per) et Cryptochrome (Cry) sont activés
par les facteurs CLOCK et BMAL1. Une fois traduits en protéines dans
le cytoplasme, des complexes PER / CRY et PER / PER reviennent dans le noyau et
inhibent la transcription régulée par CLOCK-BMAL1, et donc, leur
propre expression.
On sait aussi que plusieurs gènes impliqués
dans l’horloge biologique sont bien conservés et se retrouvent chez
de nombreuses espèces. D’autre part, on retrouve parfois plusieurs
types d’un gène donné chez une même espèce, comme
les trois types du gène Period (Per1, Per2 et Per3)
et les deux types du gène Cryptochrome (Cry1 et Cry2) dans
les neurones des noyaux
suprachiasmatiques humains. 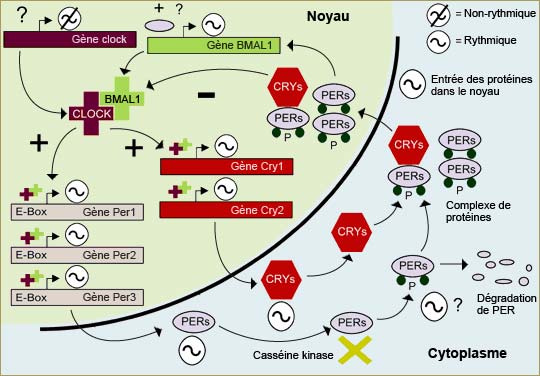
Adapté de : Whitmore, D. et
al.: A Clockwork Organ. Biological Chemistry 381, 793-800 (2000)
On
sait enfin que cette boucle de rétroaction complexe subit l'influence de
la lumière extérieure responsable de sa synchronisation avec le
cycle jour / nuit. Suite à une stimulation lumineuse qui modifie une molécule
photosensible (voir l'encadré ci-bas), on observe ainsi une
augmentation de la production de PER 1 et PER 2 dans le NSC, ce qui induit des
changements dans la progression de la boucle. 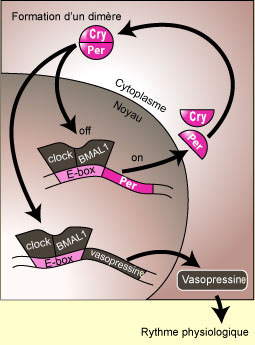 Mais
connaître les principaux rouages de l’horloge biologique, ce n’est
que résoudre la moitié du problème. En effet, cette horloge
coordonne plusieurs fonctions comme le sommeil, la température corporelle,
la sécrétion de différentes hormones. L’autre moitié
du problème, qui constitue de nos jours une part importante de la recherche
en chronobiologie, est donc celle de l’output. Autrement dit, comment
l’horloge biologique parle-t-elle à tous ces autres systèmes
? Mais
connaître les principaux rouages de l’horloge biologique, ce n’est
que résoudre la moitié du problème. En effet, cette horloge
coordonne plusieurs fonctions comme le sommeil, la température corporelle,
la sécrétion de différentes hormones. L’autre moitié
du problème, qui constitue de nos jours une part importante de la recherche
en chronobiologie, est donc celle de l’output. Autrement dit, comment
l’horloge biologique parle-t-elle à tous ces autres systèmes
?
Dans
certains cas, ce lien pourrait être une interaction directe entre les composantes
de l’horloge et le gène d’une hormone particulière.
Par exemple, CLOCK et BMAL1 se fixent sur la région « E-box »
non seulement du gène Per, mais aussi du gène de la vasopressine.
La production de la protéine PER, mais aussi celle de la vasopressine,
sera alors interrompu lorsque suffisamment de protéines PER auront pénétré
dans le noyau et se seront fixées sur le complexe CLOCK / BMAL1 pour désactiver
tant la production d’ARNm de PER que de vasopressine. Le
taux de production d’une hormone peut donc fluctuer selon un cycle de 24
heures grâce à un tel couplage intime avec les composantes de l’horloge
biologique. 
Comment cette boucle de rétroaction
complexe peut-elle subir l’influence lumineuse nécessaire à
sa synchronisation avec le cycle jour / nuit ? La question a fait couler beaucoup
d’encre, en particulier en ce qui concerne le type de photopigment permettant
aux mammifères de remettre quotidiennement en phase leur horloge biologique
avec la lumière du jour. Le débat qui a cours depuis le début
des années 2000 oppose les tenants de la mélanopsine
et ceux du cryptochrome comme premier maillon pour assurer cette
conversion de l’énergie lumineuse en signal électrique. Et
comme souvent quand il y a des batailles de clocher en science, les deux camps
disposent de données qui semblent prouver leur dire. C’est d’ailleurs
ce qui fait la beauté de ce débat.
Les
cryptochromes ont d’abord été mis en évidence dans
les cellules végétales. Les protéines CRY1 et CRY2 y déclenchent
la croissance des plantes en réponse à la lumière bleu et
ultraviolette du spectre lumineux (voir capsule outil à gauche).
On a ensuite démontré que
le cryptochrome était aussi un élément clé de la
boucle de rétroaction de l’horloge biologique des mammifères.
Chez la drosophile, il agit comme un pigment photosensible capable de réinitialiser
l’horloge biologique de la mouche. C’est donc cette protéine
qui rend possible l’adaptation du cycle circadien lors d’expériences
reproduisant les effets du décalage
horaire chez la mouche. |  Structure hypothétique de la protéine Cryptochrome.
Structure hypothétique de la protéine Cryptochrome.
Source: The Zhong group, Ohio State University |
Or pour certains chercheurs, le cryptochrome des
mammifères a définitivement perdu cette fonction photoréceptrice
encore présente chez la mouche et est devenu qu’un simple rouage
de l’horloge biologique dont l’activité ne dépend plus
de la lumière. Cette conception est appuyée par les expériences
montrant que la mouche privée de toutes ses opsines et de son cryptochrome
ne synchronise plus son cycle circadien, alors qu’une souris privée
de ses cônes, de ses bâtonnets et de ses cryptochromes conserve une
réponse résiduelle à la lumière.
Structure hypothétique de la protéine mélanopsine
du hamster Djungarian.
Source : Dr. Alexander
Lerchl
| Ces mêmes
chercheurs optent pour la mélanopsine comme photopigment pour l’entraînement
de l’horloge biologique. La mélanopsine est présente dans
un faible pourcentage de cellules ganglionnaires de la rétine (environ
1%) qui innervent le
noyau suprachiasmatique. Ces cellules ganglionnaires contenant de la mélanopsine
innervent également d’autres régions cérébrales
intéressées par l’intensité lumineuse comme celles
impliquées dans la réponse pupillaire. Si
on élimine le gène des opsines
des cônes et des bâtonnets en plus de ceux de la mélanopsine,
la souris devient complètement insensible à la photopériode.
Toutefois, si on « knock out » seulement le gène
de la mélanopsine, on ne produit qu’une modeste réduction
de l’entraînement circadien à la lumière. D’où
l’élaboration d’un modèle où les opsines et la
mélanopsine joueraient un rôle nécessaire et suffisant mais
redondant pour la photoréception circadienne chez les mammifères.
Mais tout n’est pas si simple… | Car
d’autres observations appuient un rôle du cryptochrome pour la photoréception.
Par exemple, les souris sans cônes, sans bâtonnets et sans cryptochrome
montrent une sensibilité de la réponse pupillaire 20 fois moindre
pour la lumière bleue que les souris sans cônes et sans bâtonnets
seulement. Ou encore, en privant la souris de toute source de vitamine A, on empêche
la formation de la rétinaldéhyde, le cofacteur essentiel à
toutes les opsines. Or, bien que ces animaux soient aveugles et montre une réduction
de la réponse pupillaire de l’ordre de 10 000 fois, leur transmission
aux noyaux suprachiasmatiques du signal lumineux semble peu affectée.
Contrairement aux résultats obtenus avec des souris possédant
des gènes de l’opsine rendus inactifs et n’ayant aucune réponse
à la lumière, les expériences avec des souris carencées
en vitamine A semblent paradoxalement montrer qu’il persiste une forme de
phototransduction. Celle-ci pourrait donc être attribuable aux cryptochromes,
avancent certains chercheurs.
Un nouveau modèle où
les cryptochromes et la mélanopsine travailleraient en coopération
pour générer le signal rétinohypothalamique sera donc peut-être
nécessaire pour réconcilier ces résultats apparemment contradictoires.
Mais il faudra sans doute attendre d’en savoir plus, en particulier sur
la cascade de réactions biochimiques impliquant les cryptochromes. |
|
|





 Mais
connaître les principaux rouages de l’horloge biologique, ce n’est
que résoudre la moitié du problème. En effet, cette horloge
coordonne plusieurs fonctions comme le sommeil, la température corporelle,
la sécrétion de différentes hormones. L’autre moitié
du problème, qui constitue de nos jours une part importante de la recherche
en chronobiologie, est donc celle de l’output. Autrement dit, comment
l’horloge biologique parle-t-elle à tous ces autres systèmes
?
Mais
connaître les principaux rouages de l’horloge biologique, ce n’est
que résoudre la moitié du problème. En effet, cette horloge
coordonne plusieurs fonctions comme le sommeil, la température corporelle,
la sécrétion de différentes hormones. L’autre moitié
du problème, qui constitue de nos jours une part importante de la recherche
en chronobiologie, est donc celle de l’output. Autrement dit, comment
l’horloge biologique parle-t-elle à tous ces autres systèmes
? 
