|
|
| Un livre accompagne le site depuis octobre 2024. Découvrez-le ici > |  |
|
|
|
|
|||||
|
|
|||||||
|
|
|
|
|
|
| |
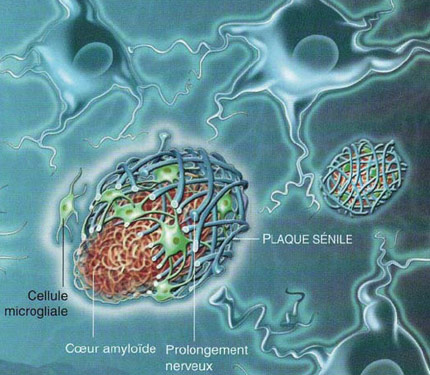
La recherche sur l’Alzheimer a été largement dominée par ce qu’on a appelé l’hypothèse amyloïde ou, par la suite, l’hypothèse synaptique bêta-amyloïde. L’accumulation anormale de la protéine bêta-amyloïde, sous forme de plaque amyloïde ou d’oligomères, est, dans cette hypothèse, considérée comme le mécanisme principal à l’origine de l’Alzheimer. Par conséquent, la majorité des médicaments et des vaccins expérimentaux visent les plaques amyloïdes. Dans le milieu, on appelle « BAPtistes » (pour « Beta-Amyloid Peptide », en anglais) les chercheurs dont les travaux s’appuient sur cette hypothèse. L’opposition principale aux BAPtistes vient des « TAUistes », c’est-à-dire ceux qui pensent plutôt que l’Alzheimer se développe suite à l’apparition des dégénérescences neurofibrillaires.
Mais les détracteurs de l’hypothèse amyloïde ne sont pas que des « TAUistes ». De plus en plus d’autres voix alternatives se font entendre. Pour justifier leurs explorations hors des sentiers battus, leurs promoteurs rappellent qu’en un quart de siècle, peu de progrès tangibles et beaucoup d’échecs ont jalonné les recherches s’inspirant de l’hypothèse amyloïde. En voici un bref aperçu. Il y a d’abord le peu de corrélations observées entre le degré des déficits cognitifs d’un patient Alzheimer et la quantité de plaques amyloïdes dans son cerveau. Une anomalie majeure au paradigme dominant connu depuis au moins le début des années 1990. Il y a aussi la présence de plaques amyloïdes chez les sujets normaux, que les défenseurs de l’hypothèse amyloïde ont bien du mal à expliquer. En fait, il peut arriver que des cerveaux dits normaux aient plus de plaques amyloïdes que le cerveau de patients sévèrement touché par l’Alzheimer, d’où l’idée défendue par Whitehouse et d’autres que les critères de diagnostic de la « maladie d’Alzheimer » sont trop flous et qu’il ne s’agit peut-être que des cas particuliers du vieillissement normal. Les relations qu’entretiennent la protéine bêta-amyloïde et la protéine tau sont aussi pour le moins complexes. On dit que les déments de type Alzheimer ont simultanément une pathologie corticale bêta-amyloïde et tau et qu’il y a une synergie entre les deux. Il ne s’agirait donc pas de choisir entre le camp des BAPtistes et celui des TAUistes puisqu’on serait en présence d’une synergie entre les deux. Et, de fait, certaines données vont en ce sens. Par exemple, une souris transgénique surexprimant à la fois la bêta-amyloïde et la protéine tau produit davantage de dégénérescences neurofibrillaires qu’une souris transgénique ayant seulement la mutation à la protéine tau. Mais le tableau demeure nébuleux. Les individus normaux peuvent par exemple avoir des dépôts de bêta-amyloïde modérés avec en même temps une dégénérescence neurofibrillaire assez avancée, jusque dans la région temporale, au stade 6 ou 7 de la pathologie tau. Et ici encore, on a des cas de patients avec une pathologie tau qui peut aller jusqu’au stade 6, sans avoir de dépôts bêta-amyloïdes. En outre, les gens âgés de plus de 75 ans ont systématiquement une pathologie tau située dans la région trans-entorhinale et entorhinale. Toutefois, celle-ci reste souvent modeste et l’on trouve des nonagénaires ayant une pathologie tau très discrète. Cela démontre une fois de plus que son développement n’est pas lié à l’âge d’une manière linéaire et systématique, bien que celui-ci soit un facteur de risque important. Plusieurs chercheurs pensent par ailleurs que les accumulations de protéines ne sont en général que les manifestations finales de maladies dont les causes sont en amont, et que les plaques amyloïdes ou les dégénérescences neurofibrillaires ne font pas exception à cette règle. Certains questionnent même directement le caractère nocif des plaques et des dégénérescences neurofibrillaires, arguant que cela pourrait être au contraire une réponse défensive du cerveau à des processus délétères en amont, comme le stress oxydatif, l’inflammation ou des dysfonctions dans le cycle cellulaire. Ainsi, contrairement à l’absence de fonction physiologique particulière de la protéine bêta-amyloïde selon l’hypothèse dominante, plusieurs études rapportent que la bêta-amyloïde se lie spécifiquement à des récepteurs ou peut induire des réactions inflammatoires. Un rôle protecteur antimicrobien a par exemple été démontré in vivo pour cette protéine. Toutefois, bien que la bêta-amyloïde puisse participer à une réponse immunitaire normale et utile à court terme, on ne peut exclure la possibilité que son activation prolongée pourrait tout de même avoir des conséquences pathologiques.
Et qu’en est-il aussi des propriétés anti-oxydantes protectrices qui ont été démontrées pour la bêta-amyloïde à 40 acides aminés? Une donnée qui, comme bien d’autres, va à l’encontre des dommages oxydatifs de l’Alzheimer attribué à la bêta-amyloïde dans l’hypothèse amyloïde (voir l'encadré ci-bas). Toutes ces données « anormales », au sens kuhnien du terme, viennent en tout cas fragiliser l’hypothèse amyloïde qui avait pris, selon certains, des allures de dogme. Le dogmatisme étant généralement une mauvaise idée, particulièrement en science, nombre de chercheurs voient plutôt d’un bon œil le foisonnement naissant d’hypothèses alternatives pour mieux comprendre et traiter ce qu’on appelle l’Alzheimer. Ils espèrent, du reste, que les organismes subventionnaires et les journaux scientifiques vont en favoriser l’émergence, ce qui est loin d’avoir toujours été le cas. Au-delà de son intérêt sociologique, voilà donc un enjeu de société important considérant les ressources investies dans le développement de traitements basés sur l’hypothèse amyloïde, et l’espoir qu’ils suscitent chez les personnes atteintes et leur famille.
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |
|
|
|
|
|
|
|
|