| |



|
|
| LES PLAQUES AMYLOÏDES ET LA DÉGÉNÉRESCENCE
NEUROFIBRILLAIRE | | Les
plaques amyloïdes et les dégénérescences neurofibrillaires
sont les deux marqueurs biologiques associés à l’Alzheimer.
Le Dr. Alois Alzheimer lui-même les avait d’ailleurs observées
chez sa patiente Auguste D., au tout début du XXe siècle (voir la
capsule histoire). Cela dit, comme le lançait en boutade un spécialiste
du cerveau : « On sait aujourd’hui presque tout sur l’Alzheimer,
excepté le rôle des plaques amyloïdes et de la dégénérescence
neurofibrillaire…. » Ces deux lésions
sont pourtant visibles en microscopie optique depuis l’époque d’Alois
Alzheimer grâce à la méthode dite « argentique »
de coloration des tissus (voir l’image ci-dessous). Un peu comme le développement
d’une photo, celle-ci amène une précipitation des sels d’argent
préférentiellement sur les structures cellulaires en forme de fibre.
Or les deux principales lésions associées à l’Alzheimer,
plaques amyloïdes et dégénérescence neurofibrillaires,
sont de nature fibrillaire et donc rendues visibles par cette méthode.
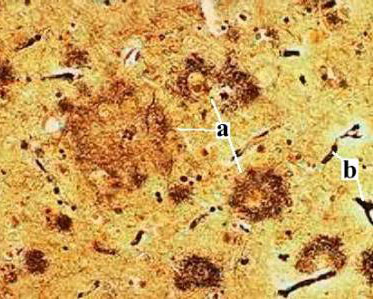
Coloration argentique d'une coupe de cortex humain.
On y distingue de multiples plaques amyloïdes (a) ainsi que des vaisseaux
sanguins (b).
| Les
plaques sont des amas fibreux de 30 à 100 micromètres de
diamètre qui s’accumulent à l’extérieur des neurones,
entre ceux-ci. Le centre de cette sphère est constitué d’un
dépôt de peptides
bêta-amyloïdes. Ces peptides sont le fruit du clivage d’une
protéine précurseure transmembranaire nommée APP (pour « Amyloid
Protein Precursor », en anglais). La bêta-amyloïde,
tout comme l’APP, est un composant normal de l'organisme, bien que sa fonction
soit encore mal comprise. | En périphérie
des plaques, des prolongements nerveux formés surtout d’axones s’enroulent
autour du centre inerte. L’aspect des plaques peut cependant s’écarter
de cette forme focale classique; les dépôts amyloïdes sont parfois
plus diffus, mal limités et dépourvus de prolongements nerveux périphériques. Le
centre amyloïde des plaques compte
aussi des cellules microgliales, les « cellules poubelles »
du cerveau, qui vont y provoquer une réaction inflammatoire modérée.
Les dégénérescences
(ou enchevêtrements) neurofibrillaires, que l’on retrouve
pour leur part à l'intérieur des neurones, sont formées
d'une substance qui s’agglutine en fibres de petit diamètre (10 nanomètres
de diamètre). Leur observation en microscopie électronique date
du début des années 1960. Après avoir d’abord cru qu’il
s’agissait de composantes normales mais modifiées des neurones, les
microtubules, Michael Kidd et son équipe ont montré qu'il s'agissait
de structures anormales constituées de filaments appariés en hélice,
les PHF (pour « paired helical filaments », en
anglais). Les éléments constitutifs
des PHF sont les
protéines tau (pour « tubulin associated unit »,
en anglais). Normalement, cette protéine se positionne perpendiculairement
aux microtubules pour en assurer la stabilité. Les microtubules peuvent
ainsi diriger le transport interne des nutriments et autres molécules à
l’intérieur de la cellule, et surtout le long de l’axone dans
le cas des neurones.
En temps normal toujours, des protéines
tau se détachent périodiquement des microtubules, mais sont remplacées
et rapidement dégradées. Mais des modifications chimiques, en l’occurrence
lorsque trop de groupements phosphates sont ajoutés à la protéine,
peuvent rendre la molécule « collante ». Les protéines
tau s’enroulent alors l’une autour de l’autre pour former les
filaments appariés en hélice. L’accumulation
de ces PHF, aussi bien dans le corps neuronal que dans ses prolongements, perturbe
la stabilité des microtubules, comprime le neurone, l’endommage et
provoque éventuellement sa mort. | 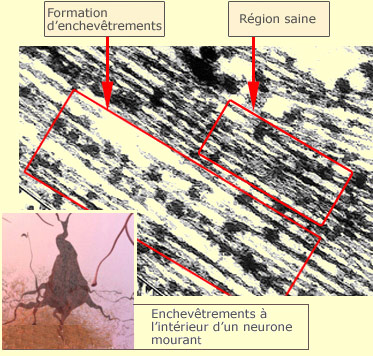
Cette photo prise au microscope électronique
montre une cellule avec des régions saines et des régions caractérisées
par une formation d'enchevêtrements.
Source : http://www.alzheimer.ca/french/alzheimer_brain_mini_site/12.htm
| Cela
entraînera des déséquilibres chimiques au niveau de la communication
neuronale et, des années plus tard, les premiers déficits
cognitifs, en particulier mnésiques. Ces
deux processus dégénératifs, plaques amyloïdes et dégénérescence
neurofibrillaire, par ailleurs fréquents au cours du vieillissement normal,
sont assez bien décrits individuellement. Le tableau est cependant moins
clair en ce qui concerne l’importance relative de chacun dans le développement
de l’Alzheimer. Plusieurs données biochimiques
et neuropathologiques tendent ainsi à montrer que les deux se potentialisent.
Les modèles animaux les plus sophistiqués comprennent d’ailleurs
des mutations aux deux protéines, tentant ainsi de reconstituer les deux
types de lésion et de modéliser leur synergie. Cette
synergie est souvent vue comme asymétrique dans la communauté scientifique.
Le courant dominant veut que l’Alzheimer s’exprime d’abord à
la suite d’une accumulation de plaques amyloïdes. Mais d’autres
chercheurs pensent que l’Alzheimer s’exprime plutôt avec l’apparition
des dégénérescences neurofibrillaires. Sans parler de toutes
les autres avenues de recherche prometteuses qui tardent à être explorées
tant l’hypothèse
amyloïde est prépondérante, bien que cela commence à
changer… |
|