|
|
|
|
|
|
 |
| De
l'embryon à la morale |
 |
|
|
|
|

 |
 |
 |
 |

 |
 |

 |
 |

 |
Lorsque
le tube neural se referme au début du développement,
certaines de ses cellules situées sur sa partie
dorsale se séparent du tube neural pour former la crête
neurale. Ces cellules vont ensuite migrer à travers
tout l’embryon. Celles de la partie rostrale de la
crête neurale vont former les ganglions des nerfs
crâniens, des ganglions parasympathiques, des cellules
de Schwann, etc. Les cellules de la partie caudale vont
pour leur part donner naissance à la racine dorsale
des ganglions, à
des ganglions sympathiques, des ganglions intestinaux, etc.
Si la route de migration de ces cellules est déterminée
par leur position le long de la crête neurale, la spécificité
finale des neurones n’est cependant pas donnée
au départ de la migration mais est plutôt fortement
influencée par l’environnement traversé
au cours de la migration.
Des expériences avec des cellules de la crête
neurale isolée en culture in vitro ont également
démontré que le choix d’un neurotransmetteur qu’un
neurone va synthétiser n’est pas complètement
pré-programmé. Au contraire, le milieu dans lequel
le neurone en développement se retrouve affecte l’expression
de ses
capacités de synthèse de neurotransmetteurs.
Des facteurs chimiques extrinsèques sont donc nécessaires
pour activer ou désactiver les gènes qui contrôlent
certains neurotransmetteurs. |
Les chercheurs ont développé
des lignées de souris avec certaines mutations qui permettent
de mieux comprendre la migration des neurones. Un des exemples
le plus connu est celui de la souris «
weaver » dont la posture est incertaine et tremblante.
Chez cette souris mutante, les cellules granulaires du cervelet
meurent avant qu'elles n'aient pu migrer dans la couche granulaire
interne et former leurs fibres parallèles. Contrairement
à ce que l’on avait d’abord cru, la mutation
n’affecterait pas la glie radiale qui guide la migration
de ces cellules granulaires, mais bien une composante d’un
canal potassique de la cellule granulaire elle-même.
Le résultat est catastrophique pour l’ensemble
des circuits du cervelet et amène les problèmes
moteurs observés chez cette souris mutante.
|
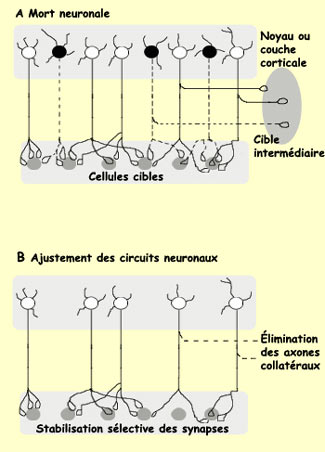
Le moment
de génération d'un neurone contribue à déterminer
sa position finale dans le cerveau et influence donc l'ensemble
de ses futures connexions. Les premiers neurones générés
au sein d'une même unité proliférative
sont localisés dans les couches les plus profondes
du cortex. Les couches profondes étant déjà
occupées, les neurones générés
plus tardivement migreront plus loin pour constituer les couches
de plus en plus superficielles du cortex. Le corollaire est
que des neurones occupant la même couche ont environ
le même âge. |
Les premiers neurones se
forment à la fin de la 4ème semaine. Dès
le 33ème jour, on constate un développement
différencié de la moelle épinière
et du cerveau. Entre le 2ème et le 5ème mois,
la formation des neurones atteint son maximum; elle s’achève
quelques mois après la naissance.
La première ébauche du cortex apparaît
après six semaines. Autour de la 10ème semaine,
les neurones commencent à
former des connexions. C’est ce réseau
de communication qui nous permettra de générer
des comportements appropriés. |
|
|
| DES CELLULES SOUCHES
AUX NEURONES |
|
Dès les premières mitoses,
le zygote entreprend
un long processus de différenciation
cellulaire. Au fil des différentes phases du développement,
les cellules vont progressivement restreindre leurs potentialités.
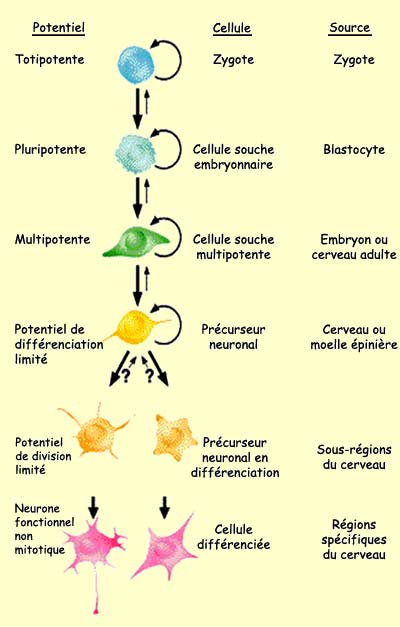
Le zygote totipotent, c’est-à-dire
capable de produire tout l’organisme, donnera d’abord
naissance à des cellules pluripotentes qui n’ont
pas cette capacité mais peuvent néanmoins donner
naissance à tous les tissus de l’organisme. Suivront
des cellules multipotentes capable de produire différentes
cellules à l’intérieur d’un tissus
particulier, et finalement des cellules spécialisées.
Comme toutes les cellules de l’organisme contiennent
le même patrimoine génétique qui provient
de nos parents, les facteurs qui vont déterminer l’emplacement,
la morphologie et la fonction d’un futur neurone est
forcément lié non pas
à la présence, mais à l’expression
de gènes spécifiques et, en bout de ligne, au
produit de ces gènes qui sont des protéines particulières
appelées facteurs de transcription (voir
capsule outil avancé
à gauche).
Dans les couches des vésicules
télencéphaliques qui formeront le cortex,
la phase de prolifération ressemble à une véritable
chorégraphie cellulaire destinée
à produire neurones et cellules
gliales.
|
|
La
prolifération cellulaire débute lorsqu’une
cellule de la zone ventriculaire envoie des projections vers
la zone marginale en direction de la pie-mère. Le noyau
de la cellule lui-même migre alors vers la périphérie
tout en subissant une réplication de son ADN. Le noyau
contenant maintenant deux copies de son matériel génétique
revient ensuite en arrière vers la surface ventriculaire.
La cellule rétracte alors ses projections périphériques
et se divise en deux.
Le destin des deux cellules filles
ainsi formées dépend
de plusieurs facteurs dont le premier est l’orientation du
plan de clivage lors de la division cellulaire. En effet, après
un clivage dans le plan vertical, les deux cellules filles demeurent
dans la zone ventriculaire et se divisent
à nouveaux. À l’opposé, un clivage dans
le plan horizontal amène la cellule qui se trouve dans le
plan le plus éloigné de la zone ventriculaire
à ne plus se diviser et à commencer sa migration
pour atteindre sa place définitive. L’autre cellule
fille demeure dans la zone ventriculaire pour continuer à
se diviser.
Le clivage vertical prédomine donc pendant les phases précoces
du développement afin d’accroître la population
de précurseurs neuronaux. Plus tard, la tendance s’inverse
et c’est le clivage horizontal qui devient la règle.
Des facteurs de transcription répartis inégalement
dans la cellule participent
à cette différenciation (voir la légende du
schéma suivant pour plus de détails ainsi que le
lien ci-bas pour des résultats plus récents qui remettent
en question cette hypothèse).

| |
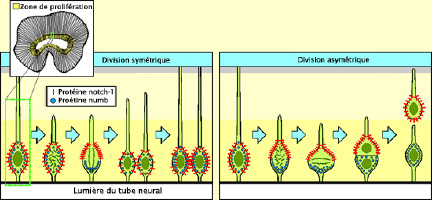
Si des facteurs de transcription
ne sont pas uniformément répartis dans
la cellule en division, alors le plan de clivage lors
de la division peut faire en sorte qu’une cellule
fille se retrouvera avec le facteur de transcription
et pas l’autre, ce qui orientera leur destin différemment.
C’est le cas des protéines appelées
notch-1 et numb qui migrent à des pôles
différents des cellules de la zone ventriculaire.
Quand les neurones se divisent verticalement, les protéines
notch-1 et numb se répartissent symétriquement.
Mais quand elles se divisent horizontalement, les protéines
notch-1 se retrouve dans la cellule fille qui s’éloigne
jusqu'à sa position finale, alors que numb reste
dans la cellule fille qui demeure en place et se divisera
à nouveau. Notch-1 semble donc à l’origine
de l’activation du programme génétique
qui conduit à l’arrêt de la division
cellulaire et à la migration de la cellule vers
son emplacement définitif.
|
|
La plupart des neuroblastes vont migrer sur
des distances appréciables à l’échelle
de l’embryon. De quelques millimètres pour atteindre
la pie-mère dans le cas du cortex des primates, à
encore bien davantage pour les neurones du système
nerveux périphérique qui proviennent de la
crête neurale.
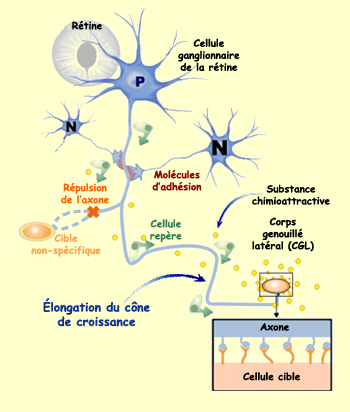
Selon leurs régions d’origine et leur destination,
les neuroblastes utilisent différentes méthodes pour
se guider lors de leur migration. Les cellules provenant des crêtes
neurales qui se destinent au système nerveux périphérique
ou encore les neurones qui vont former des groupes cellulaires constitués
en noyaux dans le cerveau s’orientent principalement grâce
à des molécules
d’adhérence spécialisées. Celles-ci
appartiennent à la matrice extracellulaire ou sont situées
à la surface d’autres cellules rencontrées en
cours de route. De plus, chaque voie de migration ainsi déterminée
offre des possibilités d’interaction avec divers environnements
cellulaires émettant des signaux inducteurs qui vont modifier
les neuroblastes en migration et contribuer à leur différenciation.
|
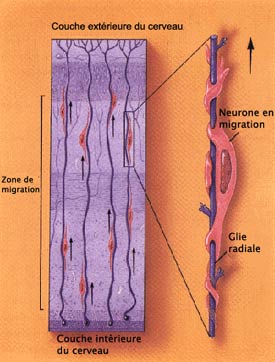
L’autre grande méthode
de migration s’observe dans les régions du
cerveau qui présentent une stratification cellulaire,
comme le
cortex cérébral, l’hippocampe ou le
cervelet. Dans ces régions, les neurones rejoignent
leur destination finale en rampant le long d’un type
particulier de cellules gliales, la glie radiale. Les neurones
en migration se déplacent donc le long de ces autoroutes,
entraînés par les affinités de ses
molécules d’adhérence avec celles de
la glie.
Un tiers des neuroblastes n’empruntent
toutefois pas cette voie de migration radiale, ce qui peut
amener une certaine dispersion horizontale des neurones corticaux
dérivant d’un même précurseur. |
Les premiers neuroblastes qui migrent à
partir de la zone ventriculaire sont destinés à la
formation d’une couche particulière appelé sous-plaque
corticale qui sera cependant appelée à disparaître
plus tard au cours du développement. Les neuroblastes destinés
à former les
six couches du cortex cérébral traversent ensuite
cette sous-plaque et forment une nouvelle couche appelée
plaque corticale. Les premières cellules
qui atteignent la plaque corticale sont celles qui vont former la
couche VI du cortex, puis arrivent celles de la couche V, puis de
la IV, et ainsi de suite de l’intérieur vers l’extérieur.
Par conséquent, les neurones nés en premier se retrouvent
dans les couches profondes du cortex alors que les plus jeunes sont
dans les couches plus superficielles. Cette migration guidée
par la glie radiale fournit aussi une explication embryologique
à l’organisation en colonne du cortex. Chaque groupe
de cellules souches de la zone ventriculaire donne ainsi naturellement
naissance à une colonne de neurones étroitement reliés
entre eux .
Les cellules de la glie radiale vont éventuellement rétracter
leur prolongement quand les neurones corticaux auront rejoint leur
destination. À la fin des processus de corticogenèse,
la zone ventriculaire ne constitue plus qu'une couche unique de
cellules épendymaires qui limite les ventricules cérébraux.
Ce ne sont pas tous
les neurones en migration qui complètent celle-ci
avec succès. Les spécialistes croient que seulement
le tiers y parvienne. Quant aux autres, ou bien ils meurent
et disparaissent durant les deux à trois semaines
que dure la migration, ou bien ils ne se différencient
jamais, ou encore ils survivent et se différencient,
mais pas au bon endroit. Ces derniers peuvent être à
l’origine de troubles variés allant de l’épilepsie à la
schizophrénie, en passant par les troubles d’apprentissage
et la dyslexie.
|
Chaque cellule prise
individuellement n’a pas à faire seule tout
le chemin qui mène à l’activation des
gènes spécifiques au rôle que joue cette
cellule dans l’organisme. De nombreuses décisions
se prennent en effet très tôt durant le développement
et tout au long de la différenciation. Comme la différenciation
est un processus qui ne revient pas en arrière, les
cellules commencent par activer des gènes responsables
de fonctions générales pour un type d’organe
donné, puis gardent pour la fin les ajustements précis
propre à la position finale qu’occupera la cellule
dans l’organe.
|
|
|